帥心濤教授團隊在腫瘤化療與免疫聯合治療領域取得重要進展
免疫治療在包括惡性腫瘤等重大疾病中有巨大的前景。現今,用單克隆抗體阻斷CTLA-4或PD-1/PD-L1通路的免疫檢查點阻斷治療已經被用于黑色素瘤/非小細胞肺癌等腫瘤的臨床治療中。免疫檢查點抑制劑解除了腫瘤原性的免疫限制并重新激活了T細胞,緻使主動免疫系統可以重新發現并消除狡猾的腫瘤細胞。然而,免疫檢查點阻斷治療的抗腫瘤效果嚴重依賴于腫瘤組織CD4+助T細胞和毒性CD8+ T細胞等抗腫瘤T細胞浸潤情況。這也就是說,大量冷腫瘤患者由于缺少這類抗腫瘤T細胞浸潤而無法受益于先進的免疫治療手段。因此,亟需開發出可提高處于免疫抑制的腫瘤對免疫檢查點阻斷治療響應的方法。
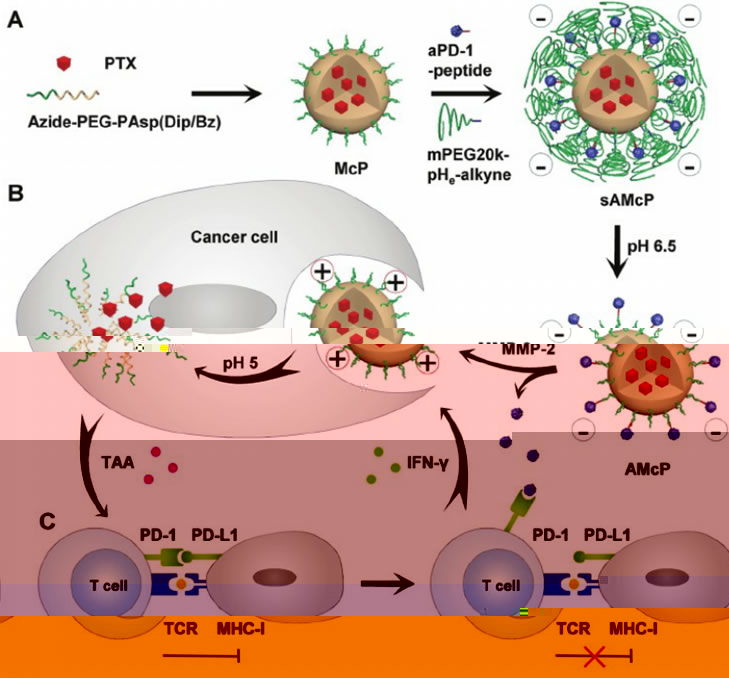
為提高抗腫瘤效果,材料科學與工程學院帥心濤教授團隊開發了一種可共輸送免疫檢查點抗PD-1抗體和化療藥物紫杉醇用于協同的腫瘤化學免疫治療的納米藥物。如圖2所示,嵌段共聚物疊氮-聚乙二醇-聚天冬氨酸(N,N’-二異丙基乙二胺/苄胺)(Azide-PEG-PAsp(Dip/Bz)) 通過自組織形成pH響應的膠束結構,其内核通過π–π堆疊作用包載了化療藥物紫杉醇。然後,通過疊氮-炔基點擊反應将MMP-2酶敏感肽偶聯的PD-1抗體和含酸敏感鍵修飾到膠束表面。PEG的“隐蔽”作用使該sAMcP納米膠束具有長循環性質,可以共輸送PD-1抗體和紫杉醇并被動聚集于腫瘤組織。進一步地,在腫瘤微環境的弱酸性(pH6.5)和高表達的MMP-2酶條件下,PEG20K和PD-1抗體觸發釋放。同時,由于負電荷抗體的脫落及Dip基團的部分質子化,膠束的表面電位由負變正,變得更容易被腫瘤細胞攝取。最後,pH敏感的膠束核響應于溶酶體的酸性快速釋放紫杉醇。體内及體外的實驗研究表明,該納米藥物共輸送紫杉醇和PD-1抗體可聯合化療和免疫治療,實現協同的抗腫瘤效果。
論文鍊接:https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.201906832 該論文于2020年1月在線發表于Small上,通訊作者為帥心濤教授,第一作者是蘇振偉博士生。


